Introductie
Doel van dit overzicht
Het doel van dit overzicht is om patiënten en ouders te informeren over de verschillende therapieën voor de Duchenne spierdystrofie (DMD) die momenteel worden onderzocht in klinische trials of na goedkeuring, om de voor- en nadelen van elke aanpak te beschrijven en om de hindernissen op te sommen die moeten worden overwonnen voordat deze therapieën kunnen worden toegepast op patiënten.
Opmerking: Er wordt veel onderzoek gedaan naar therapieën voor Duchenne en het verandert snel, waardoor het onmogelijk is om elke benadering in een kort overzicht op te nemen. Daarom wordt een algemeen overzicht van de belangrijkste benaderingen gegeven.
Het probleem
Hoe Duchenne wordt veroorzaakt
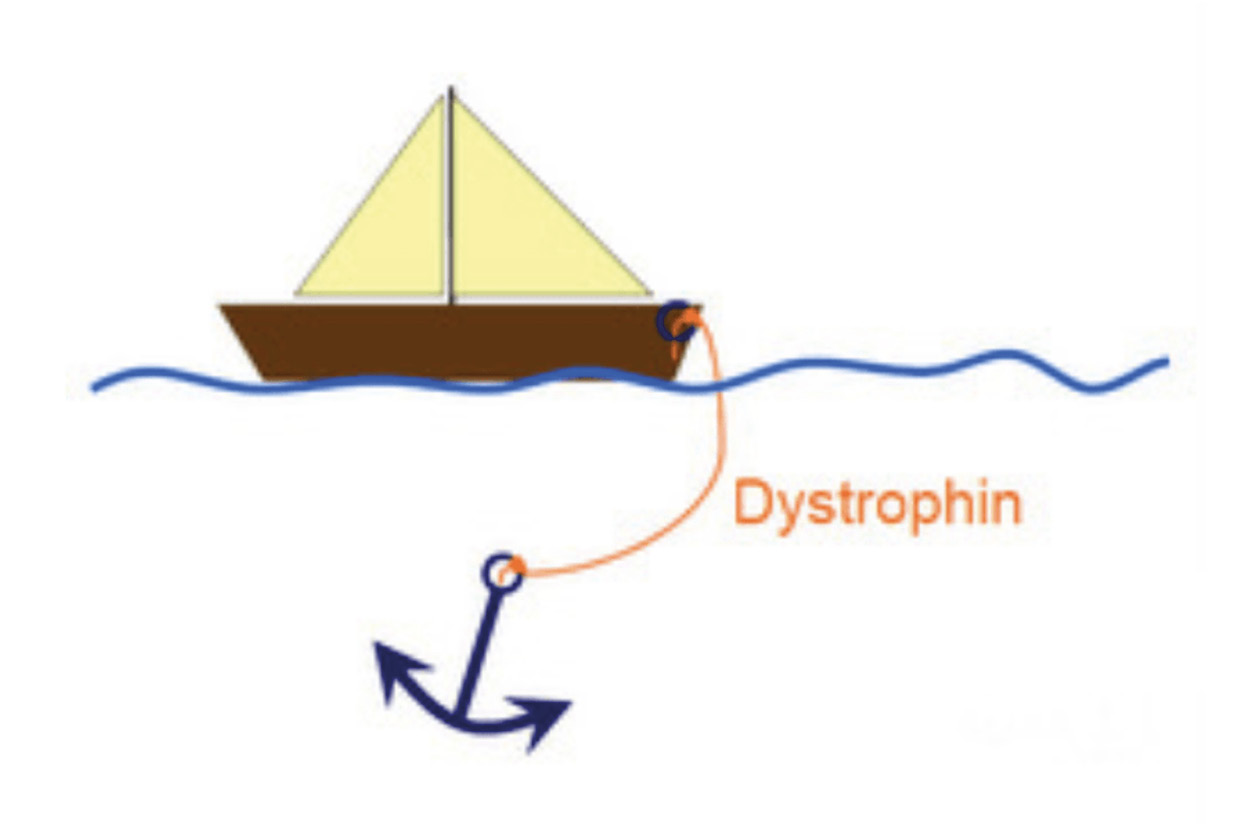
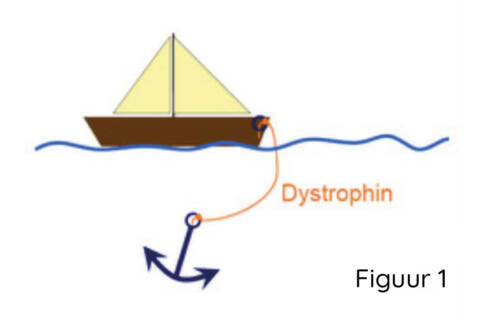
Duchenne spierdystrofie wordt veroorzaakt door mutaties (genetische fouten) die de genetische code van het DMD-gen verstoren. Dit gen wordt normaliter door spiercellen vertaald in het dystrofine-eiwit, dat het skelet van de spiervezels verbindt met de beschermende laag aan de buitenkant van de vezels. Deze link stabiliseert spiervezels tijdens het samentrekken van spiercontractie (bewegingen). Ik leg de functie van dystrofine vaak uit door de analogie van een anker (het skelet van de spier) en een boot (de beschermende laag buiten), waarbij dystrofine het touw is dat die twee verbindt (Figuur 1).
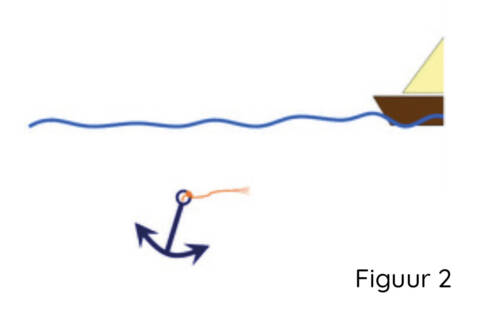
Door de verstoring van de genetische code kan de cel alleen het begin van het eiwit produceren en gaat de verbinding verloren (de boot is niet langer gekoppeld aan het anker (Figuur 2)). Daardoor beschadigen de spiervezels van Duchenne zeer gemakkelijk, zelfs tijdens normale beweging.
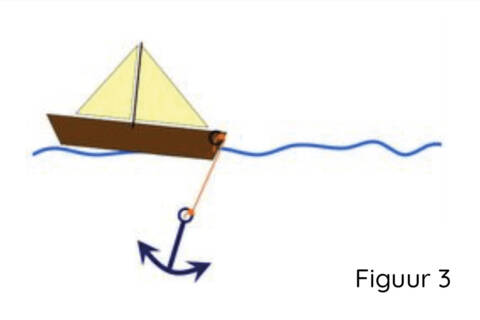
Mutaties in het DMD-gen die de genetische code niet verstoren, maken de vorming mogelijk van een dystrofine-eiwit dat gedeeltelijk functioneel is (d.w.z. het kan het anker met de boot verbinden, maar het is iets korter (Figuur 3)). Deze mutaties zijn geassocieerd met de minder ernstige Becker spierdystrofie.
PENDING: 3 COLUMN MET AFBEELDINGEN BOOT
Therapeutische ontwikkelingen
Onderzoekstraject van nieuwe therapieën
Er zijn talrijke soorten therapieën in ontwikkeling en de meerderheid volgt hetzelfde traject van preklinisch naar klinisch onderzoek. Eerst wordt de aanpak getest in gekweekte van patiënten afkomstige cellen, vervolgens in diermodellen van de ziekte (meestal de mdx-muis) en vervolgens, wanneer de resultaten in cellen en dieren voldoende overtuigend zijn, in patiënten (klinische studies). Dit deel van de therapeutische ontwikkeling kan heel lang duren, omdat er vaak onvoorziene problemen ontstaan, die overwonnen moeten worden.
Klinische studies zijn onderverdeeld in twee fasen: de studies in de vroege fase worden voornamelijk uitgevoerd om aan te tonen dat de aanpak veilig is, terwijl in latere fasestudies het doel is aan te tonen dat de behandeling zowel effectief als veilig is.
Het is goed om in gedachten te houden dat, terwijl elke stap cruciaal is, de volgende stap altijd uitdagender is. Dus als een medicijn in een eerste stap werkt (bijvoorbeeld in cellen), is dit geen garantie voor verdere successen in studies met dieren en mensen. Bovendien is het een uitdaging om te beslissen wanneer de overstap van studies in cellen en dieren naar mensen moet plaatsvinden.
Dit besluitvormingsproces kan worden gefaciliteerd door de TREAT-NMD adviescommissie voor therapieën (TACT).
Lees verder