Celtherapie voor Duchenne
Wat we nu weten
Huidige status
Preklinisch; hoewel bedrijven stamcel behandelingen aanbieden (tegen een hoge prijs), is er momenteel geen bewijs dat dit effectief is in Duchenne patienten.
Doel
Om aan Duchenne-spieren spiercellen van een gezonde donor (met een gezond gen) af te leveren om het verloren spierweefsel te vervangen en normale dystrofine productie door de donorcellen mogelijk te maken.
Achtergrond
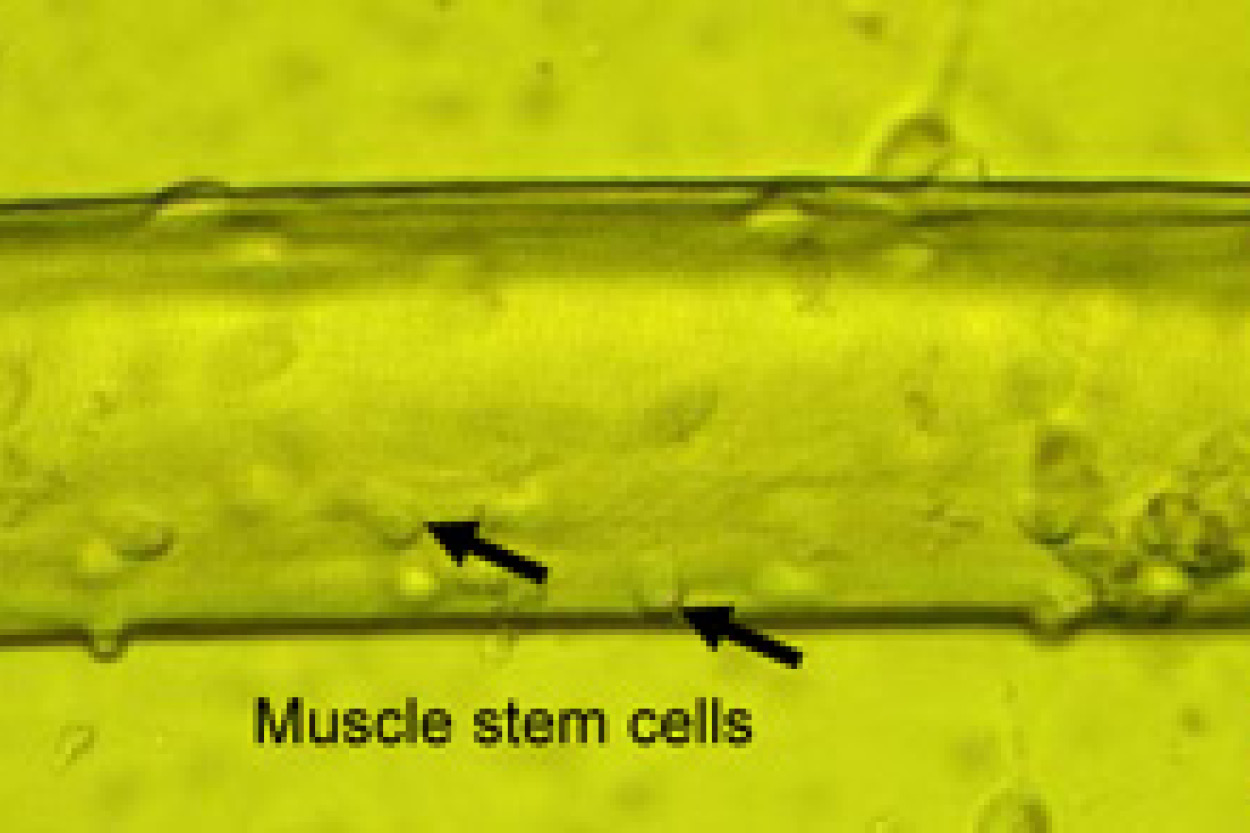
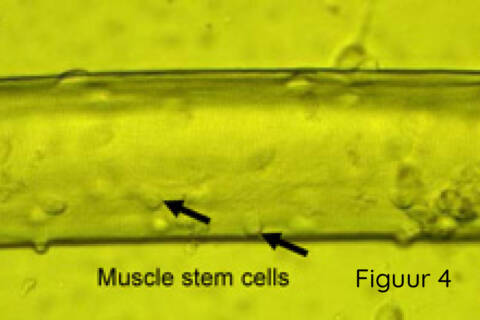
Spieren bestaan uit spiervezels die zich niet delen en spierstamcellen die bovenop de vezel liggen (Figuur 4). Wanneer de spiervezel beschadigd is, zullen deze spierstamcellen (ook wel satellietcellen of myoblasten genoemd) zich gaan delen en migreren naar de plek van de beschadiging en fuseren met de beschadigde spier om deze te repareren. Deze stamcellen kunnen geïsoleerd worden uit een spierbiopt en vermeerderd worden in het laboratorium om vervolgens getransplanteerd te worden in een Duchenne-spier.
Uitdagingen
Uitdaging 1
Spierstamcellen zijn niet in staat om zich van de bloedbaan naar de spieren te verplaatsen.
Oplossing 1
Lokale injectie in aangetaste spieren.
Uitdaging 2
Zelfs spierencellen die rechtstreeks in spieren worden geïnjecteerd, verplaatsen zich niet verder dan 1-2 mm van de injectieplek.
Oplossing 2
Voer meerdere injecties uit (bijvoorbeeld 100 in een vierkante cm). Dit is getest bij
Duchenne-patiënten (zie ook) en dystrofine-positieve cellen werden inderdaad op de injectieplaatsen waargenomen.
Klinische studie
In Canada is een klinische studie waarbij spierstamcellen werden geïnjecteerd met
100 injecties in een klein spiergebied (0,25-1 cm2) (artikelen Tremblay en Skuk). De behandeling was veilig en dystrofine-positieve vezels konden waargenomen worden in een biopt uit het behandelde gebied. Een nieuwe studie met lokale spierceltransplantatie in een onderarmspier van patiënten van 16 jaar en ouder is aan de gang in Canada.
Uitdaging 3
Desondanks is het niet haalbaar om deze vorm van behandeling te gebruiken om spiercellen te leveren aan alle spieren in het lichaam.
Oplossing 3
Er zijn andere stamcellen aanwezig in het bloed, bloedvatwanden en vetweefsel die ook kunnen bijdragen aan spiervorming. Deze cellen kunnen in het laboratorium geïsoleerd en vermeerderd worden. Een voordeel is dat deze cellen waarschijnlijk vanuit de bloedbaan naar spieren kunnen migreren, waardoor behandeling van het gehele lichaam mogelijk is.
Uitdaging 4
Hoewel deze cellen kunnen deelnemen aan spiervorming, is de efficiëntie op dit moment erg laag (<1% van de getransplanteerde cellen komt in de spieren terecht).
Lopend
In Italië is een studie gedaan waarbij CD133+ cellen verkregen werden van Duchenne-patiënten (geïsoleerd uit bloed), vermeerderd werden in het laboratorium en vervolgens terug getransplanteerd werden in handspieren van patiënten (groep van Yvan Torrente).
Toekomst
Manieren om de efficiëntie van deze aanpak te vergroten worden momenteel onderzocht.
Klinische studie
Een studie om de veiligheid van transplantatie van mesangioblasten (verkregen van niet-aangedane broers) bij Duchenne-patiënten te beoordelen, is gedaan in Italië. Vijf patiënten werden intra-arterieel geïnjecteerd met mesangioblasten. Dit was een veiligheidsonderzoek en er werd geen verbetering van de spierfunctie verwacht of gezien. Er wordt verder gewerkt aan de verbetering van het transplantatieprotocol voor mogelijke toekomstige studies.
Uitdaging 5
Het is moeilijk om voldoende stamcellen voor transplantatie te verkrijgen, omdat deze stamcellen slechts een beperkte capaciteit om te delen hebben.
Oplossing 5
Het is nu mogelijk om volwassen cellen te herprogrammeren zodat ze stamcelkenmerken krijgen (geïnduceerde pluripotente stamcellen of iPS-cellen). Deze cellen hebben een enorm capaciteit om zich te delen en kunnen zich differentiëren in alle mogelijke celtypen. Het is echter de kunst om ze alleen te laten differentiëren in spiervoorlopercellen. Er wordt momenteel gewerkt aan het genereren van iPS-cellen van klinische kwaliteit en aan de optimalisatie van de methode om spiervoorlopercellen te verkrijgen op een veilige, efficiënte en gestandaardiseerde manier.
Uitdaging 6
Transplantatie van donorspieren zal een ontstekingsreactie opwekken (zoals de transplantatie van elk weefsel in een andere persoon).
Oplossing 6a
Toediening van geneesmiddelen die het immuunsysteem onderdrukken. Dit is een standaardbehandeling voor personen die donorweefsel ontvangen. Helaas is chronische behandeling met deze geneesmiddelen niet zonder bijwerkingen (bijv. de persoon wordt vatbaarder voor infecties).
Oplossing 6b
Isoleer spiercellen van de patiënten, vermeerder ze in het laboratorium en behandel ze (bijvoorbeeld met gentherapie) in het laboratorium. Transplanteer vervolgens de eigen cellen van de patiënt terug (autologe transplantatie). Gentherapie is veel efficiënter in cellen (in het laboratorium) dan in weefsel (in een persoon). Bovendien is onderdrukking van het immuunsysteem mogelijk niet nodig, omdat de eigen cellen van de patiënt worden getransplanteerd.
Uitdaging 7
Om dit te laten werken, moeten de methodes om spiercellen of andere stamcellen efficiënt aan spieren te leveren nog steeds worden geoptimaliseerd (zie uitdaging 1-4). Bovendien is het nog steeds mogelijk dat het immuunsysteem reageert op de getransplanteerde cellen, ook al zijn ze afkomstig van de patiënt: vanwege de manipulatie in het laboratorium zijn de cellen waarschijnlijk veranderd waardoor het immuunsysteem zou kunnen reageren.
Oplossing 7
In het laboratorium is het nu mogelijk om kleine veranderingen in het DNA van een cel aan te brengen zonder een gen toe te voegen (met behulp van DNA-“scharen”. Verschillende types zijn ontwikkeld: ZNF, TALEN en RGN, ook wel CRISPR/Cas9 genoemd). Deze DNA-scharen zijn nog niet erg efficiënt. In gekweekte cellen moest de cel waarin de schaar succesvol was, geïdentificeerd (gewoonlijk slechts in ~1 op 1000 cellen) en vervolgens vermeerderd worden om getransplanteerd te worden in muismodellen.
Over het algemeen is de genetische fout in de dystrofine vrij groot en de DNA-schaar kan grote fouten niet herstellen. Het is echter mogelijk om een fout te introduceren waarmee een exon permanent verborgen kan worden (zie ‘5.1 Exon skipping’). Dit werk bevindt zich in een vroeg stadium en er zal nog heel wat werk verzet moeten worden om te beoordelen of deze methode veilig is en of deze toepasbaar is op mensen. In 2016 toonden drie publicaties in het tijdschrift Science een proof-of-concept van deze aanpak in het mdx-muismodel en in 2018 is een artikel verschenen dat proof-of-concept liet zien in een hondmodel. Hoewel dit bemoedigend is, moet men in gedachten houden dat de DNA-schaar moet worden afgeleverd aan de meeste spiercellen. Als zodanig staat het voor uitdagingen van gentherapie of celtherapie met betrekking tot de translatiestap van muizen naar grotere dieren en mensen. Daarnaast is meer onderzoek nodig om te beoordelen hoe specifiek de scharen zijn en of het veilig is om ze in mensen te gebruiken. Zie deze blog voor meer informatie.
Een andere manier om stamcellen te gebruiken
Deramiocel
Hartstamcellen kunnen mogelijk de hartpathologie tijdelijk vertragen bij Duchenne-patiënten door beschermende groeifactoren te produceren. De gezonde hartcellen worden geïsoleerd uit donorharten die voldoen aan de kwaliteitscriteria voor transplantatie, maar om logistieke redenen niet getransplanteerd konden worden. Dit effect is van voorbijgaande aard, omdat de stamcellen zullen sterven.
Capricor heeft een veiligheidsonderzoek uitgevoerd bij Duchenne-patiënten met hartaandoeningen om te beoordelen in hoeverre lokale injectie van donorhartstamcellen in het hart getolereerd wordt. De procedure werd goed verdragen en er was een kleine afname van fibrose (bindweefselvorming) waarneembaar in harten van patiënten in de behandelde groep. Verder was er een trend te zien in een verbeteringen van de functie van de bovenste ledematen wat ook suggereert dat er een beschermend effect van de stamcellen op skeletspieren is. Capricor heeft een fase 2 studie afgerond waarbij ambulante en niet-ambulante patiënten elke drie maanden behandeld werden met een intraveneuze toediening van 150 miljoen stamcellen (CAP-1002) en placebo. Deze studie werd tijdelijk stopgezet nadat twee patiënten een acute immuunrespons ontwikkelden die ziekenhuisopname noodzakelijk maakte. Patiënten krijgen daarom een voorbehandeling met corticosteroïden en antihistaminica om het risico op een ernstige immuunrespons te vermijden.
Voorlopige analyse suggereert opnieuw een verbeterde functie van de bovenste ledematen in vergelijking met placebo, hoewel dit is gebaseerd op een zeer klein aantal patiënten (8 behandelde versus 12 placebo). Patiënten die bij de klinische studie betrokken waren, kunnen de behandeling voortzetten of starten met de behandeling (degene die begonnen als placebogroep) in een open-label onderzoek. Momenteel loopt er een placebogecontroleerde fase 3 studie om de veiligheid en werkzaamheid van de behandeling met deze stamcellen te beoordelen. Het primaire eindpunt is de bovenste ledematen prestatie en het onderzoek includeert zowel ambulante als niet ambulante patiënten.
Capricor heeft een biologische vergunningsaanvraag (BLA) ingediend bij de FDA. In juli 2025 gaf de FDA aan dat zij aanvullende informatie nodig heeft om het bewijs van de werkzaamheid van deramiocel bij Duchenne-patiënten te onderbouwen, en verzocht zij tevens om extra informatie over de productie van het middel.
Lees verder